在近日由科技数据智能分析和研究平台络绎学术Online分享中,史家海带来了《从Rubius到Carmine,红细胞外囊泡颠覆递送系统的认知》的演讲。史家海具有20年创新药开发经验,曾参与戊型肝炎病毒疫苗(益可宁)开发,博士期间证明SARS冠状病毒主蛋白酶的二聚体界面是潜在的病毒药物靶点,且该靶点在新冠病毒中保守。
2010年在新加坡国立大学取得博士学位后,史家海师从美国麻省理工大学白头研究院的Harvey Lodish教授研究红细胞发育及改造红细胞为万能药物载体;2015年起任香港城市大学生物医学系助理教授和博士生导师。
 史家海介绍道,红细胞具有如下特性:没有任何遗传物质、很长的体内存活期(在人体内近120天)、能进入大循环和微循环、有极大的表面积和体积、输血(自体输血和异体输血)是一个标准的临床操作。
史家海介绍道,红细胞具有如下特性:没有任何遗传物质、很长的体内存活期(在人体内近120天)、能进入大循环和微循环、有极大的表面积和体积、输血(自体输血和异体输血)是一个标准的临床操作。这就意味着,红细胞具有天然的生物相容性、高通量的负载、低免疫原性、完全的生物可降解性,能够实现120天长效循环,以及无核不癌变等众多优点。
史家海表示,红细胞在其整个发育的过程中,会把所有除了血红蛋白和一些血红细胞专有蛋白以外的蛋白全部降解。即使在红细胞内表达绿色荧光蛋白(GFP),在分化末期红细胞也会将其全部降解。这是红细胞的一个重要特征,必须把所需的蛋白链接红细胞特有的蛋白上,才能让蛋白在红细胞内正常存在。
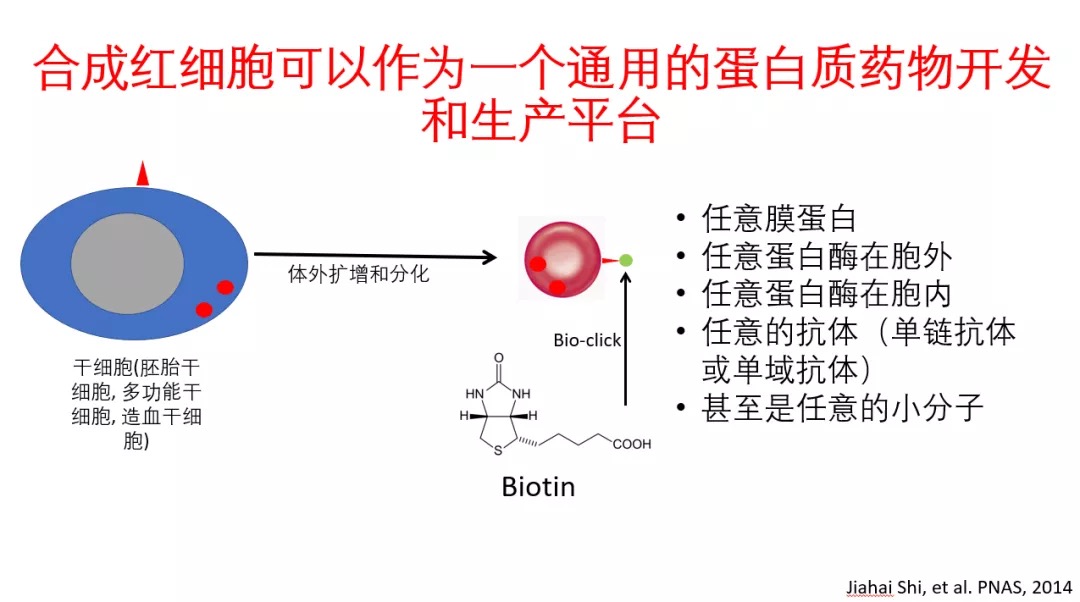
他认为,作为药物载体,合成红细胞可以作为一个通用的蛋白质药物开发和生产平台。“我们通过改造干细胞中红细胞专有蛋白,同时使干细胞在体外扩增和分化成完全去核的合成红细胞,这些合成红细胞既和正常红细胞没有太大的区别,又携带药用蛋白,进而变成药用红细胞。”
值得一提的是,史家海在博士后期间在Lodish指导下就开发了一个利用体外合成的红细胞进行体内药物输送的技术。利用该技术,Lodish于2014年在波士顿成立了新创公司Rubius Therapeutic,并于2018年在纳斯达克上市。
史家海并未止步于Rubius Therapeutic。他提到,研发过程需要资金支持、工程化红细胞的高成本让其转头对随后红细胞外囊泡展开了研究,并开发出了用于递送基因治疗工具的非病毒载体。利用此技术,史家海成为2019年创立的Carmine Therapeutic的共同科学创始人和科学顾问。
就在2020年7月,Carmine Therapeutic和武田制药达成总额为9亿美元的预付款和里程碑付款的协议,共同开发2种基因疗法。
史家海提到,其选择用红细胞生产的外囊泡,以达到减少有核细胞带来的风险问题。红细胞外囊泡大概有140 纳米左右,可以装载比较大的mRNA,这让红细胞外囊泡跟所有的LPN脂质体递送工具相比,具备突出的递送优势,可以用来输送所有的核酸药物,包括小分子化合物和长链、短链核酸药物。
史家海强调,“大”的优势拓宽了红细胞外囊泡递送药物外作为递送基因编辑工具的广阔应用场景。






